2023年中考化学金属和金属材料考点梳理
![]()
1F
考点一:金属材料
(一)、纯金属材料:纯金属(90多种)

(二)、合金(几千种):由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
1. 金属材料包括纯金属和合金两类。金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。
2. 合金可能是金属与金属组成,也可能是金属与非金属组成。金属材料中使用比较广泛的是合金。
合金的优点:
(1)熔点高、密度小;(2)可塑性好、易于加工、机械性能好;(3)抗腐蚀性能好;
下面是黄铜和铜片,焊锡和锡,铝合金和铝线的有关性质比较:
钛合金的优点:① 熔点高、密度小;② 可塑性好、易于加工、机械性能好;③ 抗腐蚀性能好
钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
钛镍合金具有“记忆”能力,可记住某个特定温度下的形状,只要复回这个温度,就会恢复到这个温度下的形状,又被称为“记忆金属”。此外,钛还可制取超导材料,美国生产的超导材料中的90%是用钛铌合金制造的。
3. 注意:(1)合金是金属与金属或金属与非金属的混合物。(2)合金的很多性能与组成它们的纯金属不同,使合金更容易适于不同的用途。(3)日常使用的金属材料,大多数为合金。(4)金属在熔合了其它金属和非金属后,不仅组成上发生了变化,其内部组成结构也发生了改变,从而引起性质的变化。
4. 2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。
5. 青铜是人类历史上使用更早的合金;生铁和钢是人类利用更广泛的合金.
6. 合金都属于混合物。
![]()
2F
考点2:金属的物理性质
(1)常温下一般为固态(汞为液态),有金属光泽。(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性(4)密度和硬度较大,熔沸点较高。 注:金属的物理性质是只所有金属都有的共同性质,而不是指某一金属的特有性质。
![]()
3F
考点3 :金属之更
(1)铝:地壳中含量更多的金属元素 (2)钙:人体中含量更多的金属元素(3)铁:目前世界年产量更多的金属(铁>铝>铜)(4)银:导电、导热性更好的金属(银>铜>金>铝)(5)铬:硬度更高的金属 (6)钨:熔点更高的金属(7)汞:熔点更低的金属 (8)锇:密度更大的金属(9)锂 :密度更小的金属
![]()
4F
考点4:金属与氧气的反应
![]()
5F
考点5:金属与酸的反应
![]()
6F
考点6:属与化合物溶液的反应
![]()
7F
考点 7 :置换反应
置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。
![]()
8F
考点8 :金属活动性顺序
1、常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2、意义:①H代表酸中的氢元素;②金属的位置越靠前,它的活动
![]()
性就越强;③在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸);④位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na)
3、应用:①用于判断金属是否与酸发生置换反应;②用于判断金属与酸发生化学反应的剧烈程度;③用于判断金属与盐能否发生置换反应。
注意:
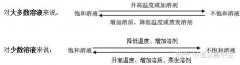
1、金属与盐的反应必须在“盐溶液”中进行,否则不能反应,如:Cu可以与AgNO3溶液反应置换出Ag,但不能与AgCl反应。
2、也可根据反应是否发生及反应剧烈程度来判断金属的活动性强弱。
3、K、Ca、Na三种金属的活动性太强,除与酸反应外,还能与水在常温下发生置换反应(如2Na+2H2O=2NaOH+H2↑),其余金属则不能
![]()
9F
考点9:矿石
1. 金属资源的存在方式:地球上的金属资源广泛存在于地壳和海洋中,大多数金属化合物性质较活泼,所以它们以化合物的形式存在;只有少数金属化学性质很不活泼,如金、银等以单质形式存在。
2. 矿石:工业上把能提炼金属的矿物叫矿石。
3. 常见矿石名称与其主要成分:
![]()
10F
考点10:一氧化碳还原氧化铁
1、炼铁的基本原理是:在高温条件下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。3CO + Fe2O3
高温
2Fe + 3CO2
2、炼铁的原料:铁矿石[常见的铁矿石有磁铁矿(主要成分是Fe3O4)和赤铁矿(主要成分是Fe2O3)]、焦炭、石灰石和空气,主要设备是高炉。(1)仪器:铁架台(2个)、硬质玻璃管、单孔橡皮赛(2个)、酒精灯、试管、酒精喷灯、双孔橡皮赛、导气管。(2)药品:氧化铁粉末、澄清石灰水、一氧化碳气(3)装置图:

(4)步骤:①检验装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;④给氧化铁加热;⑤停止加热;⑥停止通入一氧化碳。(5)现象:红色粉末逐渐变成黑色,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。(6)化学方程式:
![]()
Ca(OH)2+CO2=CaCO3↓+H2O
(7)注意事项:与CO还原氧化铜的实验操作顺序一样,即先通入CO再加热,实验完毕,停止加热,继续通入CO至试管冷却。②、实验主要现象:红色粉末变为黑色时,澄清的石灰水变
![]()
浑浊,尾气点燃产生淡蓝色火焰。③实验注意事项:先能后点,先撤后停
![]()
。
(8)尾气处理:因CO有毒,不能随意排放在空气中,处理的原则是将CO燃烧掉转化为无毒的CO2或收集备用。