2023年中考化学复习:溶解度
1、固体的溶解度
(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中更多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度
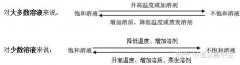
a。大多数固体物的溶解度随温度升高而升高;如KNO3
b。少数固体物质的溶解度受温度的影响很小;如NaCl
c。极少数物质溶解度随温度升高而降低。如Ca(OH)2
(4)溶解度曲线
(1)t3℃时A的溶解度为80g
(2)P点的的含义在该温度时,A和C的溶解度相同
(3)N点为t3℃时A的不饱和溶液,可通过加入A物质,降温,蒸发溶剂的方法使它变为饱和
(4)t1℃时A、B、C、溶解度由大到小的顺序C>B>A
(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。
(6)从A溶解度是80g。
(7)t2℃时A、B、C的饱和溶液各W克,降温到t1℃
会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A
(8)除去A中的泥沙用过滤法;分离A与B(含量少)的混合物,用结晶法
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素:①气体的性质②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
3、混合物的分离
(1)过滤法:分离可溶物+难溶物
(2)结晶法:分离几种可溶性物质
结晶的两种方法
a。蒸发溶剂,如NaCl(海水晒盐)
b。降低温度(冷却热的饱和溶液,如KNO3)